
|
 Diffusion:
Alle Teilchen eines gelösten Stoffes sind in ständiger Bewegung.
Kommt es in der Lösung zu einem Konzentrationsunterschied, beispielsweise
durch örtliche Zugabe von Lösungsmittel oder durch die Neubildung
einer löslichen Substanz an einer bestimmten Stelle, so entsteht
ein Konzentrationsgefälle. Diffusion:
Alle Teilchen eines gelösten Stoffes sind in ständiger Bewegung.
Kommt es in der Lösung zu einem Konzentrationsunterschied, beispielsweise
durch örtliche Zugabe von Lösungsmittel oder durch die Neubildung
einer löslichen Substanz an einer bestimmten Stelle, so entsteht
ein Konzentrationsgefälle.
Durch die Teilchenbewegung wird dieses Konzentrationsgefälle, sofern
es nicht ständig neu erzeugt wird, im Laufe der Zeit ausgeglichen.
Die spontan eintretende, gleichmäßige Verteilung eines Stoffes
in dem zur Verfügung stehenden Raum nennt man Diffusion. Die Diffusionsgeschwindigkeit
hängt, gleiche Temperatur vorausgesetzt, vor allem vom Konzentrationsgefälle
und von den Eigenschaften des diffundierenden Stoffes ab. Was für
gelöste Stoffe gilt, trifft auch für das Lösungsmittel
Wasser zu:
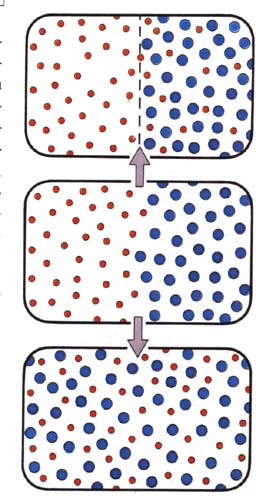
Abb. rechts: Veränderung eines Konzentrationsgefälles, oben
durch Osmose, unten durch Diffusion (Bild aus "Die Zelle")
Modell eines osmotischen Systems: Zwei Behälter sind durch
eine semipermeable (selektiv durchlässige) Membran getrennt. Die
Porengröße ist ausreichend, um kleinen Partikeln (Ionen, Molekülen)
einen ungehinderten Durchlass zu gewähren; sie verhindert den Durchgang
der großen. Es baut sich daher im linken Behälter ein höherer
osmotischer Druck auf, da sich jedes Partikel mit einer Hydrathülle
umgibt. Da jener Behälter mehr "wasserbindende" Partikel
enthält, dehnt sich das Volumen aus.
 Der osmotische
Druck (Turgor): delta P ist messbar. Hierbei sind: psi = das Wasserpotential,
delta P = der hydrostatische Druck, sigma = das Verhältnis von scheinbarem
zu theoretischem osmotischen Druck in Abhängigkeit von der Semipermeabilität
der Membran und pi = der osmotische Druck des Behälters (Zelle). Der osmotische
Druck (Turgor): delta P ist messbar. Hierbei sind: psi = das Wasserpotential,
delta P = der hydrostatische Druck, sigma = das Verhältnis von scheinbarem
zu theoretischem osmotischen Druck in Abhängigkeit von der Semipermeabilität
der Membran und pi = der osmotische Druck des Behälters (Zelle).
Osmose:
Ist die Konzentration des Wassers auf beiden Seiten einer Membran gleich
groß, ändert sich an diesem Zustand, statistisch betrachtet,
nichts, obwohl ständig Wassermoleküle in beiden Richtungen durch
die Membran hindurch wandern. Je höher die Temperatur, umso stärker
ist diese Teilchenbewegung. Ist die Membran zwischen zwei Lösungen
hauptsächlich für das Lösungsmittel durchlässig, für
andere Teilchen aber kaum, wird sie als halbdurchlässige oder semipermeable
Membran bezeichnet. Die Durchlässigkeit einer Membran hängt
in der Regel von ihrer Porengröße ab. Befinden sich auf beiden
Seiten der Membran Lösungen unterschiedlicher Wasserkonzentration,
dann werden in Richtung niedrige Wasserkonzentration im gleichen Zeitraum
mehr Wassermoleküle durch die Membran treten als umgekehrt. Man spricht
von Osmose.
Unter Osmose versteht man den Nettofluss von Wasser durch eine halbdurchlässige
Membran hindurch.
isotonisch: Der osmotische Druck auf beiden Seiten der Membran ist
gleich.
hypotonisch: Die Konzentration einer gelösten Substanz (z.B.
in der Zelle) ist niedriger als in der Vergleichslösung (z.B. der
Umgebung der Zelle)
hypertonisch: Die Konzentration einer gelösten Substanz ist
höher als in der Vergleichslösung. Wasser wandert so lange aus
einer hypotonischen in eine hypertonische Lösung ein, bis beide isotonisch
sind.
Osmose und biologische Membranen; Turgor:
Jede Zelle hat stets mit osmotischen Erscheinungen zu kämpfen. Zellwandlose
Zellen in wässriger Lösung sind in der Regel hypertonisch, d.h.,
es erfolgt in sie ein kontinuierlicher Wassereinstrom, der seinerseits
einen Druck von innen auf die Membran ausübt. Bei einigen Ciliaten
(z.B. Paramecium) und Flagellaten (z.B. Euglena) wird es mittels pulsierender
Vakuolen wieder herausgepumpt.
Rote Blutkörperchen
(Erythrozyten) kommen normalerweise in einer isotonischen Umgebung
(Blutplasma) vor. Verdünnt man Blut mit Wasser, platzen die Zellen,
da die Membran dem osmotischen Druck des Zellinneren nicht standhält.
Man kann das Platzen unterbinden, wenn man das Blut mit einer isotonischen
Lösung (0,9 prozentige NaCl-Lösung = physiologische Kochsalzlösung)
verdünnt.
Bei Pflanzenzellen ist die Situation nur deshalb anders, weil sie in
der Regel von einer elastisch dehnbaren Zellwand umgeben sind. Bringt
man sie in eine hypotonische Lösung, können sie nur so lange
Wasser aufnehmen, bis ein Ausgleich des Wasserpotentials innen und außen
erreicht ist; innen steht das Wasser trotz höherer Konzentration
der osmotisch wirksamen Substanzen unter einem zusätzlichen hydrostatischen
Druck, dem Turgor. Das ermöglicht den Pflanzenzellen, in ihren
Vakuolen Ionen, Zucker, organische Säuren, Aminosäuren u.a.
in beträchtlichen Konzentrationen zu speichern.
Durch Wasseraufnahme baut sich intrazellulär ein entsprechend
hoher hydrostatischer Druck auf. Der auf die Wand ausgeübte Druck
(Turgor) spielt eine entscheidende Rolle zum Erhalt der Stabilität
und Steifheit pflanzlicher Gewebe. Jede Zelle übt dabei Druck auf
die benachbarten aus. In der Summe baut sich daher eine beträchtliche
Gewebespannung auf. Pflanzenzellen, die wie reife Kirschen einen süßen,
konzentrierten Zellsaft besitzen, können sogar platzen, wenn es regnet
oder wenn sie in Wasser gelegt werden. Der osmotische Druck in ihren
Zellen übersteigt dann die Festigkeit der Zellwand.
Plasmolyse: Bringt man aber prallgefüllte Zellen in konzentrierte
Zuckerlösung, dann löst sich das Plasma mit seiner begrenzenden
Membran von der Zellwand ab und legt sich als Plasmahülle um die
geschrumpfte Vakuole. Diesen Vorgang nennt man Plasmolyse.
Bilder: Bauer, Bossler: "Die Zelle", Cornelsen-Velhagen &
Klasing
|


