Humangenetik (Krankheiten):
Die ständige Konfrontation mit der Geburt behinderter Kinder, die
geistige und körperliche Anomalien aufweisen, führt notgedrungen
zu verstärkten Bestrebungen, die Ursachen dieser Defekte zu erfassen
und möglichst frühzeitig zu erkennen. Wie Untersuchungen gezeigt
haben, sind in drei von vier Fällen die Behinderungen genetisch bedingt.
Es handelt sich dabei entweder um Gendefekte auf den Chromosomen oder
um Chromosomenanomalien. Auch in diesem Zusammenhang müssen wir davon
ausgehen, dass es sich in allen Fällen um eine Erbveranlagung handelt,
deren Umsetzung im äußeren Erscheinungsbild (Krankheit, Missbildung)
vielfach von Umweltbedingungen abhängig ist. Heute kennt man über
3 300 monogene Erbleiden, die entweder rezessiv oder dominant verlaufen
und von den Autosomen oder dem X-Chromosom (Geschlechts- oder Heterochromosom)
vererbt werden.
Eine der wichtigsten Aufgaben der Humangenetik ist es daher, durch die
Klärung der ursächlichen Zusammenhänge die Voraussetzungen
für vorbeugende und heilende Maßnahmen zu liefern. Wir wollen
in der Folge an einigen ausgewählten Beispielen die Erbgänge
von Krankheiten und die Möglichkeiten einer Hilfeleistung besprechen.
Autosomal rezessiver Erbgang bei Krankheiten:
Einige Beispiele:
Albinismus (Pigmentausfall) 1:15000
Kretinismus (Hormonmangelkrenkheit der Schilddrüse; gestörte
Körper und Gehirnentwicklung) 1:50000
Phenylketonurie (PKU) (eine Stoffwechselkrankheit - bewirkt Schwachsinn)
1:10000
Galaktosämie (eine Stoffwechselkrankheit - bewirkt Brechdurchfall,
Gelbsucht, Trübung der Augenlinse, Schwachsinn) 1:20000
Mucoviscidose (zähflüssiger Drüsenschleim in der Lunge,
Schädigung innerer Organe) 1:2000
Hasenscharte (Oberlippe gespalten) 1:1000
Ein schweres Erbleiden, bei dem es der humangenetischen Forschung gelungen
ist, einen Weg zur Vermeidung von Organschäden zu finden, ist die
Phenylketonurie (PKU). Grundlage dafür war in erster Linie die
Erkennung der Krankheitsursache. Bei der PKU handelt es sich um einen
genbedingten (mutationsbedingten) Enzymausfall, der zur Anreicherung eines
Zwischenprodukts aus dem Eiweißstoffwechsel, dem Phenylalanin, im
Blut des Neugeborenen führt. Dies tritt jedoch erst bei der Aufnahme
eiweißreicher Nahrung nach der Geburt ein. Phenylalanin, das normalerweise
in der Leber in Tyrosin umgewandelt wird, reichert sich in hoher Konzentration
im Blut an und stört so die Stoffwechselprozesse des Gehirns. Die
Folge ist das Auftreten hochgradigen Schwachsinns bei den Betroffenen.
Durch die Verabreichung genau dosierter phenylalaninarmer Kost bis etwa
zum 15. Lebensjahr wird eine Gehirnschädigung vermieden. Die Gehirnentwicklung
ist bis zu diesem Zeitpunkt anscheinend so weit fortgeschritten, dass
kein Organdefekt mehr auftritt.
Einen ähnlichen Verlauf nimmt die Galaktosämie, bei
der, infolge eines Enzymausfalls, die Galaktose (ein Bestandteil des Milchzuckers)
nicht abgebaut werden kann. Durch eine milchzuckerfreie Diät kann
auch in diesem Fall eine Schädigung des Gehirns verhindert werden.
Man kennt heute zwei Möglichkeiten, durch vorbeugende Maßnahmen
das Auftreten von schweren Entwicklungsstörungen zu verhindern. Keine
der Maßnahmen kann allerdings die eigentliche Ursache der Krankheit,
den Genschaden, beseitigen. Die Gentechnieker versprechen zwar eine (auf
genetische Grundlage angelegte) Heilung (Gentherapie), doch davon ist
man noch sehr weit entfernt.Die Erkennung der ursächlichen Zusammenhänge
gibt uns jedoch die Möglichkeit, Schaden zu vermeiden. Erster Ansatzpunkt
einer Prophylaxe ist die Austestung der Eltern. Trotz scheinbarer Gesundheit
können sie nämlich heterozygote Genträger sein, bei denen
eine verdeckte (rezessive) Erbkrankheit erst in ihren homozygoten Kindern
zum Ausbruch kommt. Heute ist dies für über 60 verschiedene
Stoffwechselkrankheiten mit Hilfe des so genannten Heterozygotentests
erreichbar. Gemessen wir dabei die Enzymaktivität der Eltern. Ist
diese deutlich geringer als die einer homozygoten gesunden Vergleichsperson,
so liegt ein heterozygotes Allel vor. Die Austestung der Eltern erfolgt
jedoch aufgrund der vielen Möglichkeiten nur gezielt und in begründeten
Fällen.
Im Falle der PKU verabreicht man den Testpersonen hohe Dosen Phenylalanin.
Bei Heterozygoten steigt daraufhin der Phenylalaningehalt im Blut stärker
an als bei Homozygoten. Dafür erhöht sich bei Gesunden deutlich
der Tyrosingehalt.
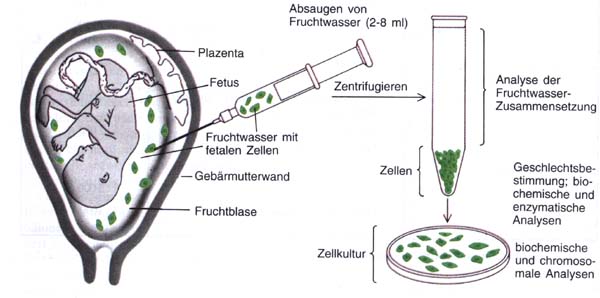
Die zweite Möglichkeit einer Vorsorge liegt in der Früherkennung
des Erbschadens. Dies kann bereits während der Schwangerschaft durch
Amniozentese oder bei den Neugeborenen erfolgen. Für die Amniozentese
wird etwa im 4. Schwangerschaftsmonat mittels einer in die Fruchtblase
(Amnionhöhle) eingeführten Kanüle eine Probe des Fruchtwassers
entnommen. Dieses enthält neben fetalem Urin und anderen Ausscheidungen
auch fetale Zellen. Nach der Auftrennung durch Zentrifugieren werden
sowohl die Zellen (in Zellkulturen) als auch das Fruchtwasser biochemisch,
enzymatisch und chromosomal analysiert.
Autosomal dominante Vererbung von Krankheiten:
Einige
Beispiele:
Kurzfingrigkeit (kurze, zum Teil verwachsene Finger) 1:170000
Vielfingrigkeit (überzählige Finger und Zehen) 1:5000
Spalthand und Spaltfuß (Missbildung durch Verwachsung von Fingern
und Zehen) 1:100000
Veitstanz (Nervenkrankheit mit Muskelkrämpfen) 1:15000
Zum Unterschied von den rezessiven Krankheiten, bei denen es sich meist
um genbedingte Enzymschäden handelt, sind bei den dominanten Erbgängen
vorwiegend Strukturgene betroffen. Da im heterozygoten Zustand neben den
normalen auch abnormale Proteine in die Körperstrukturen eingebaut
werden, kommt es zu krankhaften Veränderungen ganzer Organe. Dies
führt dazu, dass die meisten dominant vererbten Krankheiten einen
tödlichen (letalen) Verlauf nehmen.
Besonders deutlich werden die Zusammenhänge bei einem kranken polyphänen
Gen, dem Marfan-Gen. Dieses codiert ein Protein, das die Elastizität
der Bindegewebsfasern bestimmt. Bei einem Genschaden kommen Bindegewebsfasern
mit erhöhter Dehnbarkeit zur Ausbildung, die in den verschiedensten
Organen eingebaut werden und zu letalen Schäden führen (z. B.
Überlänge der Gliedmaßen, Deformationen an Linse und Augapfel,
Herzklappenfehler, überdehnbare Sehnen und Gelenkskapseln sowie unterentwickelte
Skelettmuskulatur).
Geschlechtschromosomale Vererbung von Krankheiten:
Vor allem zwei Krankheiten sind im Zusammenhang mit geschlechtschromosomengebundener
Vererbung bekannt geworden. Es sind dies die Rotgrünblindheit und
die Bluterkrankheit.
Die Rotgrünblindheit wird rezessiv vererbt, ihr Gen liegt auf dem
X-Chromosom. Rotgrünblinde Frauen sind daher immer homozygot, und
alle Söhne dieser Frauen sind ebenfalls rotgrünblind. Heterozygote
Frauen sind normalsichtig, geben jedoch die Krankheit an die nächste
Generation weiter. Man bezeichnet diese Anlagenträgerinnen als Überträgerinnen.
Gleiches wie für die Rotgrünblindheit gilt auch für die
Bluterkrankheit. Am Blutgerinnungsvorgang sind 13 Faktoren beteiligt.
Alle haben ihren Sitz auf dem X-Chromosom. Je nachdem, welche Gene ausfallen,
variieren die Krankheitsbilder von einer Verzögerung der Blutgerinnung
bis zu deren völligem Ausfall. Im letzten Fall führt schon eine
sonst harmlose Verletzung zum Verbluten des Betroffenen.
An einem 1938 bekannt gewordenen Erbgang, an dem sowohl Rotgrünblindheit
als auch Bluterkrankheit beteiligt waren, konnte erstmals ein Crossing-over
beim Menschen nachgewiesen werden. Bei einem Mann traten beide Krankheiten
auf; ihre Anlagen mussten in diesem Fall gekoppelt auf dem X-Chromosom
liegen. Die Tochter des Mannes war phänotypisch gesund. Sie war jedoch
für beide Gendefekte Überträgerin. Aus der Ehe dieser heterozygoten
Tochter und einem gesunden Mann gingen 4 Söhne hervor. Diese zeigten
in ihrem Phänotyp alle Kombinationsmöglichkeiten der beiden
Anlagen, nämlich gesund, bluterkrank, rotgrünblind und bluterkrank/
rotgrünblind. Dieser Erbgang war nur mit einem Austausch der gekoppelten
Gene zu erklären.
Chromosomenanomalien als Ursache von Krankheiten:
Den Zusammenhang zwischen einem Chromosomendefekt und einem Krankheitssyndrom
(gr. Syndrome = Zusammenlauf; Krankheitsbild aus verschiedenen Symptomen)
entdeckte der Franzose Lejeune im Jahre 1959. Er analysierte erstmals
eine Chromosomenanomalie beim Menschen und erkannte im Vorhandensein eines
überzähligen Chromosoms Nr. 21 die Ursache für den so genannten
"Mongolismus".
Seit dieser Entdeckung gehören Chromosomenanalysen zu den Standarduntersuchungen
im Rahmen der Familienberatung. In der Zwischenzeit sind zahlreiche Veränderungen
sowohl an der Zahl als auch an der Struktur menschlicher Chromosomen bekannt
geworden. Entsprechend unterscheidet man zwischen numerischer und struktureller
Chromosomenaberration.
Entwicklungsstörungen durch veränderte Chromosomenzahlen:
Veränderungen in der Zahl der Chromosomen sind relativ häufig.
Sie treten in einem Verhältnis von 1:160 bei Neugeborenen auf. Die
Ursache für eine Unter- oder Überzahl von Chromosomen liegt
in einer Störung der Meiose (Reduktionsteilung), bei der die homologen
Chromosomenpaare ungleich verteilt werden. Es entstehen so Keimzellen,
die entweder 21 oder 23 Autosomen enthalten. Verschmilzt eine derartige
anomale Keimzelle mit einer normalen Keimzelle (Befruchtung), so kommt
es entweder zur Bildung einer monosomen Zygote, der ein Chromosom fehlt,
oder einer trisomen Zygote mit einem überschüssigen Chromosom.
Während monosome Zygoten entwicklungsgestört sind, ist die Entwicklung
der trisomen Zygote schwer gestört (Trisomie).
Die bedeutsamste Chromosomenkrankheit des Menschen ist an die Trisomie-21
gebunden, bei der das Chromosom Nr. 21 dreifach vorliegt. Das damit verbundene
Krankheitsbild wird als Down Syndrom ("Mongolismus")
bezeichnet.
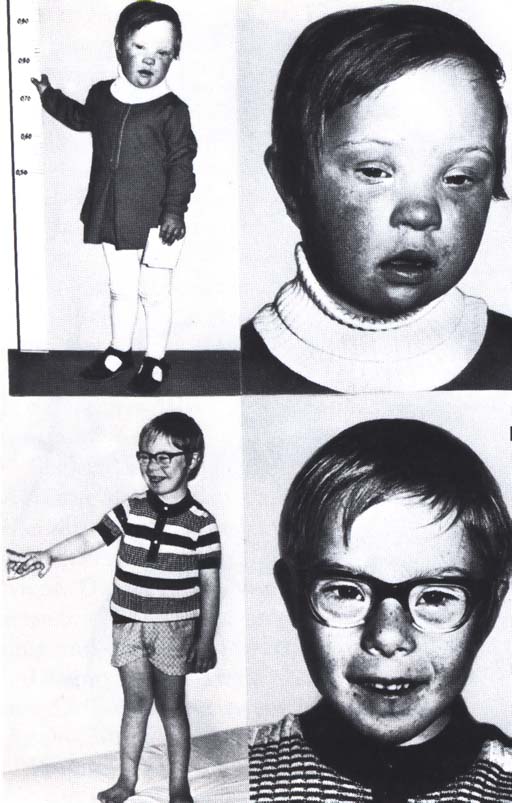
Bild: Kinder mit Down-Syndrom (Trisomie-21, Mongolismus);
(Bild aus Passarge)
Der bei diesem Syndrom auftretende Schwachsinn ist wahrscheinlich auf
eine durch den trisomalen Zustand bedingte Enzymüberproduktion zurückzuführen.
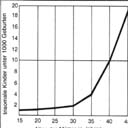 Auffällig
ist auch das deutliche Ansteigen der Häufigkeit der Trisomie in Abhängigkeit
vom Alter der Eltern. Liegt sie bei Müttern unter 30 Jahren noch
bei etwa 0,04 %, so steigt diese nach dem 40. Lebensjahr auf etwa 3 %
an. Auffällig
ist auch das deutliche Ansteigen der Häufigkeit der Trisomie in Abhängigkeit
vom Alter der Eltern. Liegt sie bei Müttern unter 30 Jahren noch
bei etwa 0,04 %, so steigt diese nach dem 40. Lebensjahr auf etwa 3 %
an.
Abbildung rechts: Häufigkeit von Chromosomenanomalien in Abhängigkeit
vom Alter der Mütter.
Auch bei den Geschlechtschromosomen ist man auf gestörte Chromosomenverhältnisse
gestoßen. Sie führen alle entweder zu schweren Defekten bei
der Ausbildung der Geschlechtsorgane und -merkmale, oder sie wirken letal.
Die auftretenden Krankheitsbilder haben alle den Charakter von Syndromen:
--> Das Turner Syndrom (X0-Monosomie): Die Betroffenen sind
phänotypisch weiblich, kleinwüchsig und infantil. Es kommt zu
keiner Ausbildung funktionsfähiger Eierstöcke und der sekundären
Geschlechtsmerkmale. Dies scheint der einzige Fall beim Menschen zu sein,
bei dem eine Unterzahl von Chromosomen eine Entwicklung der Kinder zulässt.
Allerdings sterben bereits 95 % der Embryonen;
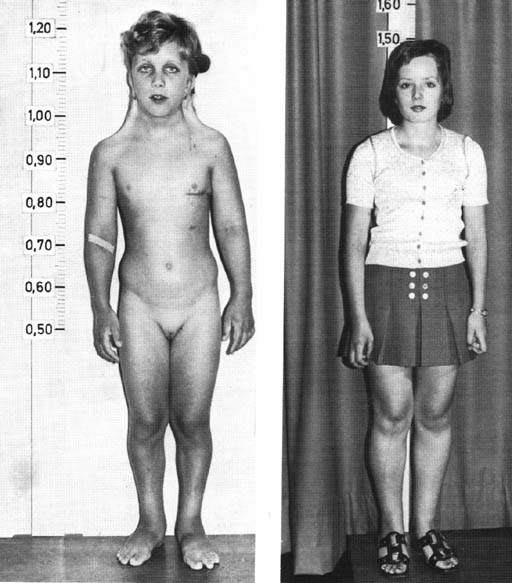
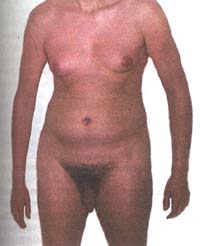 Bild
oben: Turner-Syndrom (rechts nach einer kosmetischen Operation); (Bild
aus Passarge). Bild
oben: Turner-Syndrom (rechts nach einer kosmetischen Operation); (Bild
aus Passarge).
--> das Klinefelter-Syndrom (XXY-Trisomie): Betroffene Menschen
entwickeln zwar einen männlichen Körperbau, der durch besondere
Langbeinigkeit und eunuchoide Züge (hohe Stimme, fehlender Bartwuchs)
gekennzeichnet ist, die angelegten männlichen Geschlechtsorgane sind
jedoch meist unterentwickelt. Manchmal wird erst bei der Suche nach der
Ursache einer Kinderlosigkeit die Störung entdeckt. Der Test ergibt
bei diesen Männern den Nachweis eines Barr-Körperchens.
Bild rechts: Klinefelter: Kleine Hoden, weibliche Formen; (Bild aus
Zetkin/Schaldach: "Lexikon der Medizin" (Ullstein);
Das Barr-Körperchen, auch als Sex-Chromatin bezeichnet, wird
als ein in  der
frühen der
frühen 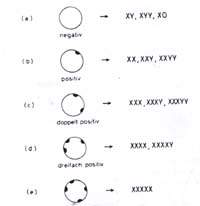 Embryonalphase
inaktiviertes X Chromosom angesehen. Es ist ein typisches Kennzeichen
der Frau und fehlt den Zellen des Mannes. Darauf stützt sich auch
der so genannte "Sextest"; wie er heute vor großen
Wettkämpfen bei Leistungssportlern vorgeschrieben ist. Dabei werden
Zellen der Testpersonen (Mundschleimhaut, Haarwurzelzellen) einem speziellen
Färbeverfahren unterzogen, wodurch das Barr-Körperchen in ihnen
deutlich hervortritt. Kein Barr-Körperchen steht für ein X-Chromosom
(Männer), ein Barr-Körperchen für 2 X-Chromosmen (Frauen)
usw. Embryonalphase
inaktiviertes X Chromosom angesehen. Es ist ein typisches Kennzeichen
der Frau und fehlt den Zellen des Mannes. Darauf stützt sich auch
der so genannte "Sextest"; wie er heute vor großen
Wettkämpfen bei Leistungssportlern vorgeschrieben ist. Dabei werden
Zellen der Testpersonen (Mundschleimhaut, Haarwurzelzellen) einem speziellen
Färbeverfahren unterzogen, wodurch das Barr-Körperchen in ihnen
deutlich hervortritt. Kein Barr-Körperchen steht für ein X-Chromosom
(Männer), ein Barr-Körperchen für 2 X-Chromosmen (Frauen)
usw.
Vor allem die Analysen der Chromosomenanomalien haben den Beweis erbracht,
dass die Y-Chromosomen bei der Ausbildung der männlichen Geschlechtsmerkmale
eine übergeordnete Rolle spielen. Das Fehlen eines Y-Chromosoms führt
in jedem Fall zur Ausbildung eines weiblichen Organismus.
Anomalien der Geschlechtschromosomen erklären auch das Auftreten
verschiedener Arten von Zwittern beim Menschen.
Entwicklungsstörungen durch Strukturveränderungen an den Chromosomen:
Bei manchen Säuglingen tritt ein typisches katzenähnliches
Schreien auf, das auf eine Fehlentwicklung des Kehlkopfs zurückzuführen
ist. Man spricht vom so genannten Katzenschreisyndrom. Diese Säuglinge
bleiben zusätzlich in ihrer körperlichen und geistigen Entwicklung
stark zurück. Die Ursache dieses (mit einer Häufigkeit von 1:50000
auftretenden) Krankheitsbildes erkannte man 1963. Es handelt sich um eine
Chromosomenmutation, bei der die Chromosomenstruktur des 5. Chromosoms
verändert wurde. Am kurzen Arm des Chromosoms tritt ein Bruchstückverlust
(= Deletion) auf.
Im Falle einer anderen strukturellen Chromosomenveränderung
kommt es zu einem Stückaustausch zwischen nicht homologen Chromosomen
(Translokation). Bleiben bei diesem Austausch die Centromeren der Chromosomen
erhalten, treten keine ersichtlichen Folgen ein (balancierte Translokation).
Wird jedoch auch ein Centromer übertragen, so dass Chromosomen ohne
Centromer und andere mit zwei Centromeren entstehen, so sterben die Zellen
bei der ersten Teilung ab. Treten Translokationen an Keimzellen auf, so
führt dies meistens zu Erbanomalien, oder es kommt zu Fehlgeburten.
Bilder:
Eberhard Passarge: "Elemente der klinischen Genetik" (G. Fischer,
Stuttgart)
|


